Azo binafsha - Azo violet
 | |
| Ismlar | |
|---|---|
| IUPAC nomi 4-[(E) - (4-Nitrofenil) diazenil] benzol-1,3-diol | |
| Boshqa ismlar (E) -4 - [(4-Nitrofenil) diazenil] benzol-1,3-diol 4- (4-nitrofenil) azobenzol-1,3-diol Magneson I p-Nitrofenilazoresorsinol 4-nitrofenilazoresorsinol | |
| Identifikatorlar | |
3D model (JSmol ) | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| ECHA ma'lumot kartasi | 100.000.735 |
| EC raqami |
|
PubChem CID | |
| UNII | |
CompTox boshqaruv paneli (EPA) | |
| |
| |
| Xususiyatlari | |
| C12H9N3O4 | |
| Molyar massa | 259,318 g mol−1 |
| Tashqi ko'rinishi | to'q qizildan jigarranggacha kristall kukun |
| Zichlik | 1,45 g / sm3 |
| 1 g / L H2O; 4 g / l etanol | |
| Xavf | |
| o't olish nuqtasi | 261,7 ° S (503,1 ° F; 534,8 K) |
Boshqacha ko'rsatilmagan hollar bundan mustasno, ulardagi materiallar uchun ma'lumotlar keltirilgan standart holat (25 ° C [77 ° F], 100 kPa da). | |
| Infobox ma'lumotnomalari | |
| Azo binafsha (pH ko'rsatkichi ) | ||
| pH 11.0 dan past | pH 13.0 dan yuqori | |
| 11.0 | ⇌ | 13.0 |
Azo binafsha (4- (4-nitrophenylazo) resorcinol) (yoki p-nitrobenzeneazoresorcinol) azo birikmasi bilan kimyoviy formula C12H9N3O4. Bu tijorat binafsha bo'yoq sifatida va eksperimental ravishda a sifatida ishlatiladi pH ko'rsatkichi, pH 11 ostida sariq, pH 13 dan yuqori binafsha rangda ko'rinadi.[1] Shuningdek, u mavjudligida chuqur ko'k rangga aylanadi magniy ozgina gidroksidi yoki asosiy muhitda tuz.[2][3] Azo binafsha rang mavjudligini tekshirish uchun ham ishlatilishi mumkin ammoniy ionlari[iqtibos kerak ]. Ammoniy xloridning rangi yoki ammoniy gidroksidi eritma ishlatiladigan azo binafsha kontsentratsiyasiga qarab o'zgaradi.
Xususiyatlari

Murakkab rang o'z nomini olgan intensiv rang nurlanish va kengaytirilgan kengayishning keyingi qo'zg'alishi va gevşemesinden kelib chiqadi π elektron R-N = N-R ’bog'langan fenollar bo'ylab tizim. Ushbu elektronlarning yutilishi .ning ko'rinadigan mintaqasiga to'g'ri keladi elektromagnit spektr. Azo binafsha qizg'in indigo rang (λmaksimal 432 nm) ga yaqin Pantone R: 102 G: 15 B: 240.
Sintez
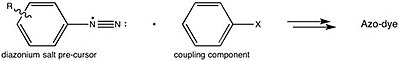
Azo binafsha rang reaksiya yordamida sintez qilinishi mumkin 4-nitroanilin bilan azot kislotasi (yaratilgan) joyida bilan kislota va a nitrit tuz ) ishlab chiqarish diazonyum oraliq. Bunga reaksiya beriladi rezortsinol, erigan natriy gidroksidi echim, orqali azo mufta reaktsiya.
Bu tayyorgarlik bo'yicha umumlashtirilgan strategiyaga mos keladi azo bo'yoqlar.
Reaktivlik
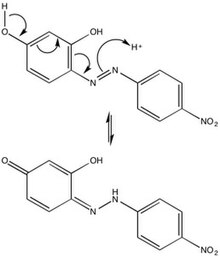
Azo violetning kimyoviy xarakterini uning azo guruhiga (-N = N-), oltita a'zoli halqalarga va gidroksil yon guruhlariga bog'lash mumkin. Sterik repulsiyalar tufayli azo binafsha eng barqaror trans-konfiguratsiya, lekin izomerizatsiya nurlanish bilan azo bo'yoqlarning kam uchraydigan holati. The paragraf- lavozim tautomerizatsiya of azo violet kislotali muhitda birikmaning harakati va shu bilan uni asos sifatida ishlatilishi to'g'risida mexanik tushuncha beradi pH ko'rsatkichi.
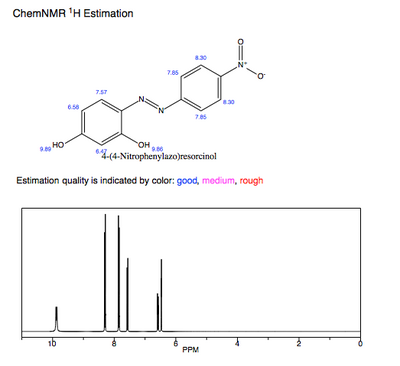
Bashorat qilingan 1H-NMR sof azo binafsha rang eng ko'p gidroksil protonlarni ko'rsatadi o'chirilgan va kislotali protonlar. Ushbu gidroksil guruhlarining konjuge qilingan tizimga elektron xayr-ehson qilishdagi ishtiroki azo binafsha rangga ta'sir qiladi.maksimal va pKa qiymat.
Adabiyotlar
- ^ "Coo-Parmerdan Azo Violet 25GM". Koul-Parmer. Arxivlandi asl nusxasi 2016 yil 28 oktyabrda. Olingan 28 oktyabr 2016.
- ^ Feygl, F.; G'azab, V. (2012-12-02). Noorganik tahlildagi spot testlar. Elsevier. ISBN 9780444597984.
- ^ Gopalan, R. (2009-01-01). Bakalavrlar uchun noorganik kimyo. Universitetlar matbuoti. ISBN 9788173716607.