Mis (II) nitrat - Copper(II) nitrate
 | |
 | |
| Ismlar | |
|---|---|
| IUPAC nomi Mis (II) nitrat | |
| Boshqa ismlar Kuprik nitrat | |
| Identifikatorlar | |
| |
3D model (JSmol ) | |
| ChEBI | |
| ChemSpider | |
| ECHA ma'lumot kartasi | 100.019.853 |
PubChem CID | |
| RTECS raqami |
|
| UNII | |
CompTox boshqaruv paneli (EPA) | |
| |
| |
| Xususiyatlari | |
| Cu (YO'Q3)2 | |
| Molyar massa | 187,5558 g / mol (suvsiz) 241,60 g / mol (trihidrat) 232,591 g / mol (gemipentahidrat) |
| Tashqi ko'rinishi | ko'k kristallar gigroskopik |
| Zichlik | 3,05 g / sm3 (suvsiz) 2,32 g / sm3 (trihidrat) 2,07 g / sm3 (geksahidrat) |
| Erish nuqtasi | 114 ° C (237 ° F; 387 K) (suvsiz, parchalanadi) 114,5 ° C (trihidrat) 26,4 ° C (geksahidrat, parchalanadi) |
| Qaynatish nuqtasi | 170 ° C (338 ° F; 443 K) (trihidrat, parchalanadi) |
| trihidrat:[1] 381 g / 100 ml (40 ° C) 666 g / 100 ml (80 ° C) geksahidrat:[1] 243,7 g / 100 ml (80 ° C) | |
| Eriydiganlik | ichida juda eriydigan hidratlar etanol, ammiak, suv; ichida erimaydi etil asetat |
| +1570.0·10−6 sm3/ mol (~ 3H2O) | |
| Tuzilishi | |
| ortorombik (suvsiz) romboedral (gidratlar) | |
| Xavf | |
| Asosiy xavf | Tirnash xususiyati beruvchi, oksidlovchi |
| Xavfsizlik ma'lumotlari varaqasi | Cu (YO'Q3)2· 3H2O |
| NFPA 704 (olov olmos) | |
| NIOSH (AQSh sog'lig'iga ta'sir qilish chegaralari): | |
PEL (Joiz) | TWA 1 mg / m3 (Cu sifatida)[2] |
REL (Tavsiya etiladi) | TWA 1 mg / m3 (Cu sifatida)[2] |
IDLH (Darhol xavf) | TWA 100 mg / m3 (Cu sifatida)[2] |
| Tegishli birikmalar | |
Boshqalar anionlar | Mis (II) sulfat Mis (II) xlorid |
Boshqalar kationlar | Nikel (II) nitrat Sink nitrat |
Boshqacha ko'rsatilmagan hollar bundan mustasno, ulardagi materiallar uchun ma'lumotlar keltirilgan standart holat (25 ° C [77 ° F], 100 kPa da). | |
| Infobox ma'lumotnomalari | |
Mis (II) nitrat, Cu (YOQ3 )2, bu noorganik birikma bu ko'k rangni hosil qiladi kristall qattiq. Suvsiz mis nitrat chuqur ko'k-yashil kristallarni hosil qiladi va azizlar vakuumda 150-200 ° S da.[3] Mis nitrat ham besh xil bo'lib uchraydi hidratlar, eng keng tarqalgani gemipentahidrat va trihidrat.
Mis nitratining sintezi va reaktsiyalari

Hidratlangan mis nitratini suvsiz materialni hidratsiya qilish yoki mis metalini an bilan davolash orqali tayyorlash mumkin suvli eritma ning kumush nitrat yoki konsentratsiyalangan azot kislotasi:[4]
- Cu + 4 HNO3 → Cu (YO'Q3)2 + 2 H2O + 2 YO'Q2
Suvsiz Cu (YO'Q3)2 mis metall bilan ishlov berilganda hosil bo'ladi N2O4:
- Cu + 2 N2O4 → Cu (YO'Q3)2 + 2 YO'Q
Har qanday gidratlangan mis (II) nitratlarini isitish orqali suvsizlantirishga urinish o'rniga Cu (NO) oksidlarini beradi.3)2. 80 ° C da gidratlar "asosiy mis nitrat" (Cu) ga aylanadi2(YO'Q3) (OH)3), bu 180 ° C da CuO ga aylanadi.[4] Ushbu reaktivlikdan foydalanib, mis nitratidan hosil bo'lish uchun foydalanish mumkin azot kislotasi uni parchalanguncha qizdirib, tutunlarni to'g'ridan-to'g'ri suvga o'tkazing. Ushbu usul. Ning so'nggi bosqichiga o'xshaydi Ostvald jarayoni. Tenglamalar quyidagicha:
- 2 Cu (YO'Q3)2 → 2 CuO + 4 NO2 + O2
- 3NO2 + H2O → 2HNO3 + YO'Q
Tabiiy asosiy mis nitratlariga noyob minerallar kiradi gerhardtit va rouayt, ikkalasi ham Cu ning polimorflari2(YO'Q3) (OH)3 modda.[5][6][7] Keyinchalik murakkab, asosiy, gidratlangan va xloridli tabiiy tuz buttgenbaxit.[8][7]
Tuzilishi
Suvsiz mis (II) nitrat
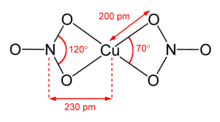
Suvsiz mis (II) nitrat ikkiga bo'lingan solvat -ozod polimorflar.[9][10] a- va b-Cu (NO3)2 to'liq 3D koordinatsion polimer tarmoqlari. Alfa shaklida faqat bitta Cu muhiti bor, u [4 + 1] koordinatsiyasiga ega, ammo beta formada ikkita turli xil mis markazlari mavjud, biri [4 + 1] va biri kvadrat planar. Nitrometan solvatida, shuningdek, "[4+ 1] muvofiqlashtirish" mavjud bo'lib, to'rtta qisqa Cu-O bog'lanishlari taxminan 200 pm va bitta uzoqroq bog'lanish kechqurun 240 da.[11] Ular koordinatsion polimerlar, mis (II) markazlari va nitrat guruhlarining cheksiz zanjirlari bilan. Gaz fazasida mis (II) nitratida ikkita bititratli nitrat ligandlari mavjud (yuqori o'ngdagi rasmga qarang).[12] Shunday qilib, qattiq bug'lanishyorilish "mis (II) nitrat molekulasini berish.
Hidratlangan mis (II) nitrat
Besh hidratlar xabar qilingan: monohidrat (Cu (NO.)3)2· H2O),[10] sesquhidrat (Cu (NO.)3)2· 1,5H2O),[13] gemipentahidrat (Cu (NO.)3)2· 2,5 soat2O),[14] trihidrat (Cu (NO.)3)2· 3H2O),[15] va geksahidrat ([Cu (H2O)6] (YO'Q3)2).[16] Geksahidrat juda qiziq, chunki Cu-O masofalari barchasi teng bo'lib, odatdagi ta'sirini ko'rsatmaydi Jahn-Tellerning buzilishi aks holda oktahedral Cu (II) komplekslariga xosdir. Ushbu nojo'ya ta'sir kuchlilarga tegishli vodorod bilan bog'lanish bu Cu-O bog'lanishlarining elastikligini cheklaydi.
Ilovalar
Mis (II) nitrati turli xil dasturlarni topadi, ularning asosiysi uning konversiyasiga aylanadi mis (II) oksidi sifatida ishlatiladi katalizator turli jarayonlar uchun organik kimyo. Uning echimlari to'qimachilik va boshqa metallar uchun polishing agentlarida qo'llaniladi. Mis nitratlari ba'zilarida uchraydi pirotexnika.[4] Ko'pincha maktab laboratoriyalarida kimyoviy moddalarni namoyish qilish uchun ishlatiladi volta hujayrasi reaktsiyalar. Bu ba'zi bir keramika sirlari va metall patinalarning tarkibiy qismidir.
Organik sintez
Mis nitrat, bilan birgalikda sirka angidrid, nitratlash uchun samarali reaktiv hisoblanadi xushbo'y deb nomlanuvchi birikmalar Menke nitratsiyasi metall nitratlari nitratsiya uchun samarali reaktiv ekanligini kashf etgan gollandiyalik kimyogar sharafiga.[17]Loyga singib ketgan gidratlangan mis nitrat "Claycop" nomli reaktiv beradi. Olingan ko'k rangli loy loy kabi, masalan, oksidlanish uchun ishlatiladi tiollar ga disulfidlar. Claycop ditioasetallarni karbonilga aylantirish uchun ham ishlatiladi.[18] Bunga bog'liq reaktiv montmorillonit uchun foydali ekanligini isbotladi nitratlash aromatik birikmalar.[19]
Adabiyotlar
- ^ a b Perrys 'Chem Eng qo'llanmasi, 7-nashr
- ^ a b v Kimyoviy xavf-xatarlarga qarshi NIOSH cho'ntak qo'llanmasi. "#0150". Mehnatni muhofaza qilish milliy instituti (NIOSH).
- ^ Pass va Satkliff (1968). Amaliy noorganik kimyo. London: Chapman va Xoll.
- ^ a b v H. Ueyn Richardson "Mis aralashmalari" Ullmannning Sanoat kimyosi entsiklopediyasi 2005 yil, Vili-VCH, Vaynxaym. doi:10.1002 / 14356007.a07_567.
- ^ https://www.mindat.org/min-1680.html
- ^ http://www.mindat.org/min-10588.html
- ^ a b https://www.ima-mineralogy.org/Minlist.htm
- ^ https://www.mindat.org/min-811.html
- ^ Devor ishlari, S. C .; Addison, W. E. (1965). "Suvsiz nitratlarning kristalli tuzilmalari va ularning komplekslari. I qism. Mis (II) nitratning a shakli". J. Chem. Soc. 1965: 2925–2933. doi:10.1039 / JR9650002925.
- ^ a b Troyanov, S. I .; Morozov, I. V.; Znamenkov, K. O .; Yu; Korenev, M. (1995). "Yangi mis (II) nitratlarining sintezi va rentgen tuzilishi: Cu (NO3)2· H2O va? -Modifikatsiyasi Cu (NO3)2". Z. Anorg. Allg. Kimyoviy. 621: 1261–1265. doi:10.1002 / zaac.19956210727.
- ^ Duffin, B .; Wallwork, S. C. (1966). "Suvsiz nitratlarning kristalli tuzilishi va ularning komplekslari. II. 1: 1 mis (II) nitrat-nitrometan kompleksi". Acta Crystallographica. 20 (2): 210–213. doi:10.1107 / S0365110X66000434.
- ^ LaVilla, R. E.; Bauer, S. H. (1963). "Gazli mis (II) nitratning elektron difraksiyasi bilan aniqlanadigan tuzilishi". J. Am. Kimyoviy. Soc. 85 (22): 3597–3600. doi:10.1021 / ja00905a015.
- ^ Dornberger-Shiff, K .; Leciejewicz, J. (1958). "Zur Struktur des Kupfernitrates Cu (YO'Q3)2.1.5H2O ". Acta Crystallogr. 11: 825–826. doi:10.1107 / S0365110X58002322.
- ^ Morosin, B. (1970). "Cu ning kristalli tuzilishi (NO3)2.2.5H2O ". Acta Crystallogr. B26: 1203–1208. doi:10.1107 / S0567740870003898.
- ^ J. Garaj, Sbornik Prac. Kimyo-Technol. Fak. Svst., Cskosl. 1966, 35-39 betlar.
- ^ Zibaseresht, R .; Hartshorn, R. M. (2006). "Hexaaquacopper (II) dinitrat: Jahn-Teller buzilishining yo'qligi". Acta Crystallogr. E62: i19 – i22. doi:10.1107 / S1600536805041851.
- ^ Menke JB (1925). "Nitratlar bilan nitratlash". Recueil des Travaux Chimiques des Pays-Bas. 44: 141. doi:10.1002 / recl.19250440209.
- ^ Balogh, M. "Mis (II) nitrat-K10 Bentonitli gil" Organik sintez uchun reagentlar entsiklopediyasida (Ed: L. Paket) 2004, J. Vili va Sons, Nyu-York. doi:10.1002 / 047084289X.
- ^ Kollet, Kristin (1990). "Gillarni to'g'ridan-to'g'ri aromatik nitratsiya". Angewandte Chemie International Edition ingliz tilida. 29 (5): 535–536. doi:10.1002 / anie.199005351.
Tashqi havolalar
- Milliy ifloslantiruvchi inventarizatsiya - Mis va aralashmalar to'g'risidagi ma'lumotlar varag'i
- ICSC Mis va aralashmalar haqidagi ma'lumot varaqasi

