Oltin (III) xlorid - Gold(III) chloride
 | |
 | |
 | |
| Ismlar | |
|---|---|
| IUPAC nomi Oltin (III) triklorid | |
| Boshqa ismlar Aurik xlorid Oltin triklorid | |
| Identifikatorlar | |
3D model (JSmol ) | |
| ChEBI | |
| ChemSpider | |
| ECHA ma'lumot kartasi | 100.033.280 |
PubChem CID | |
| RTECS raqami |
|
| UNII | |
CompTox boshqaruv paneli (EPA) | |
| |
| |
| Xususiyatlari | |
| AuCl3 (Au sifatida mavjud2Cl6) | |
| Molyar massa | 606,6511 g / mol |
| Tashqi ko'rinishi | Qizil kristallar (suvsiz); oltin, sariq kristallar (monohidrat)[1] |
| Zichlik | 4,7 g / sm3 |
| Erish nuqtasi | 254 ° C (489 ° F; 527 K) (parchalanadi) |
| 68 g / 100 ml (sovuq) | |
| Eriydiganlik | ichida eriydi efir, suyuqlikda ozgina eriydi ammiak |
| −112·10−6 sm3/ mol | |
| Tuzilishi | |
| monoklinik | |
| Kvadrat planar | |
| Xavf[2] | |
| Asosiy xavf | Irritant |
| Xavfsizlik ma'lumotlari varaqasi | Qarang: ma'lumotlar sahifasi |
| GHS piktogrammalari |  |
| GHS signal so'zi | Ogohlantirish |
| H315, H319, H335 | |
| P261, P305 + 351 + 338 | |
| Tegishli birikmalar | |
Boshqalar anionlar | Oltin (III) ftor Oltin (III) bromid |
Boshqalar kationlar | Oltin (I) xlorid Kumush (I) xlorid Platina (II) xlorid Merkuriy (II) xlorid |
| Qo'shimcha ma'lumotlar sahifasi | |
| Sinishi ko'rsatkichi (n), Dielektrik doimiy (εr), va boshqalar. | |
Termodinamik ma'lumotlar | Faza harakati qattiq-suyuq-gaz |
| UV nurlari, IQ, NMR, XONIM | |
Boshqacha ko'rsatilmagan hollar bundan mustasno, ulardagi materiallar uchun ma'lumotlar keltirilgan standart holat (25 ° C [77 ° F], 100 kPa da). | |
| Infobox ma'lumotnomalari | |
Oltin (III) xlorid, an'anaviy ravishda chaqiriladi aurik xlorid, kimyoviy moddadir birikma ning oltin va xlor. Bilan molekulyar formula Au2Cl6, oltin triklorid nomi soddalashtirilgan bo'lib, AuCl empirik formulasini nazarda tutadi3. The Rim raqamlari nomida oltinning an borligini bildiring oksidlanish darajasi oltin birikmalari uchun odatiy bo'lgan +3 dan. Oltin bilan bog'liq bo'lgan yana bir xlorid mavjud, oltin (I) xlorid (AuCl). Xloraurik kislota, HAuCl4, oltin eritilganda hosil bo'lgan mahsulot akva regiya, ba'zida "oltin xlorid" yoki "kislotali oltin triklorid" deb nomlanadi. Oltin (III) xlorid juda yaxshi gigroskopik va suvda yaxshi eriydi etanol. U 160 ° C dan yuqori yoki nurda parchalanadi.
Tuzilishi
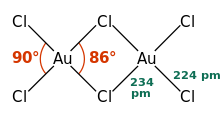
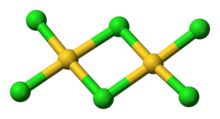
AuCl3 sifatida mavjud ko'pikli xlorid dimer ham qattiq, ham bug 'sifatida, hech bo'lmaganda past haroratlarda.[3] Oltin (III) bromid o'xshash harakat qiladi.[1] Tuzilishi shunga o'xshash yod (III) xlorid.
Oltin (III) xloridda har bir oltin markaz to'rtburchaklar tekis,[1] d bo'lgan metall majmuaga xos bo'lgan8 elektronlar soni. AuCl tarkibidagi birikma3 ma'lum darajada ko'rib chiqiladi kovalent.
Tayyorgarlik
Oltin (III) xlorid ko'pincha xlorli gazni 180 ° C da oltin kukuni ustiga o'tkazib tayyorlanadi:[1]
- 2 Au + 3 Cl2 → Au2Cl6
Tayyorgarlikning yana bir usuli - Au reaksiyaga kirishishdir3+ tetrakloroaurat ishlab chiqarish uchun xlorli turlar. Uning kislotasi, xloraurik kislota, keyin yo'q qilish uchun isitiladi vodorod xlorid gaz. Bilan reaktsiya akva regiya oltin (III) xlorid ishlab chiqaradi:
- Au(lar) + 3 YOQ−
3(aq) + 6 H+(aq) U Au3+(aq) + 3 YO'Q2(g) + 3 H2O(l) - Au3+(aq) + 3 NOCl(g) + 3 YOQ−
3(aq) → AuCl3(aq) + 6 YO'Q2(g) - AuCl3(aq) + Cl−(aq) ⇌ AuCl−
4(aq) - 2 HAuCl4(lar) → Au2Cl6(lar) + 2 HCl(g)
Reaksiyalar

Suv bilan aloqa qilishda, AuCl
3 kislotali gidratlar va konjugat asosini hosil qiladi [AuCl
3(OH)]−
. U kamayishi mumkin Fe2+
eritmadan elementar oltin tushishini keltirib chiqaradi.[1]
Suvsiz AuCl3 parchalana boshlaydi AuCl 160 ° C atrofida; ammo, bu o'z navbatida yuz beradi nomutanosiblik yuqori haroratlarda oltin metall va AuCl beradi3.
- AuCl3 → AuCl + Cl2 (> 160 ° C)
- 3 AuCl → AuCl3 + 2 Au (> 420 ° C)
AuCl3 bu Lyuis kislotali va osonlikcha shakllantiradi komplekslar. Masalan, u bilan reaksiyaga kirishadi xlorid kislota shakllantirmoq xloraurik kislota (HAuCl
4):
- HCl + AuCl
3 (aq) → H+
+ [AuCl
4]−
Kabi boshqa xlorid manbalari KCl, shuningdek, AuCl-ni o'zgartiring3 ichiga AuCl−
4. AuCl ning suvli eritmalari3 kabi suvli asos bilan reaksiyaga kirishadi natriy gidroksidi shakllantirish cho'kma Au (OH)3, u ortiqcha NaOH ni eritib, natriy aurat (NaAuO) hosil qiladi2). Agar yumshoq qizdirilsa, Au (OH)3 parchalanadi oltin (III) oksidi, Au2O3va keyin oltin metallga.[4][5][6][7][8]
Oltin (III) xlorid ko'plab boshqa oltin birikmalarini sintez qilish uchun boshlang'ich nuqtadir. Masalan, bilan reaksiya siyanid kaliy suvda eriydi murakkab, K [Au (CN)4]:
- AuCl
3 + 4 KCN → K [Au (CN)
4] + 3 KCl
Organik sintezdagi dasturlar
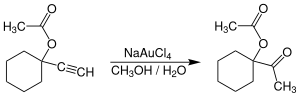
AuCl3 turli xil reaktsiyalar uchun engil kislota katalizatori sifatida organik kimyogarlarning qiziqishini uyg'otdi,[9] garchi hech qanday transformatsiyalar tijoratlashtirilmagan bo'lsa ham. Oltin (III) tuzlar, ayniqsa Na [AuCl4] (AuCl dan tayyorlangan3 + NaCl ) ga muqobil variantni taqdim eting simob (II) kabi tuzlar katalizatorlar o'z ichiga olgan reaktsiyalar uchun alkinlar. Illyustrativ reaktsiya - bu ishlab chiqarish uchun terminal alkinlarning hidratsiyasi atsetil birikmalar.[10]
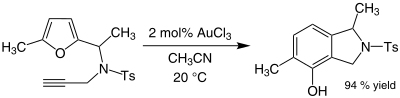
Ba'zi alkinlar ta'sir ko'rsatadi aminatsiya oltin (III) katalizatorlar ishtirokida. Oltin kataliz qiladi alkillanish albatta aromatik halqalar va konvertatsiya qilish furanlar ga fenollar. Masalan, ning aralashmasi asetonitril va oltin (III) xlorid alkillanishini katalizlaydi 2-metilfuran tomonidan metil vinil keton 5-pozitsiyada:
Buning samaradorligi organogold reaktsiyasi diqqatga sazovordir, chunki furan ham, keton ham kislotali sharoitda polimerizatsiya kabi yon reaktsiyalarga sezgir. Ba'zi hollarda qaerda alkinlar mavjud, fenollar ba'zan hosil bo'ladi (Ts =tosil ):[11]
Ushbu reaktsiya yangi aromatik halqa beradigan qayta tashkil etishni o'z ichiga oladi.[12]
Stexiometrik reaktiv sifatida aurik xlorid benzol (va boshqa turli xil arenalar) bilan juda yumshoq sharoitda (xona haroratida bir necha daqiqa) reaksiyaga kirishib dimerik fenilgold (III) dikloridga ega bo'ladi:[13]
PhH + ½ Au2Cl6 → ½ [PhAuCl2]2 + HCl
Adabiyotlar
- ^ a b v d e Egon Wiberg; Nils Viberg; A. F. Xolman (2001). Anorganik kimyo (101 ed.). Akademik matbuot. 1286–1287 betlar. ISBN 978-0-12-352651-9.
- ^ "Oltin xlorid". Amerika elementlari. Olingan 22 iyul, 2019.
- ^ E. S. Klark; D. H. Templeton; C. H. Makgillavri (1958). "Oltin (III) xloridning kristalli tuzilishi". Acta Crystallogr. 11 (4): 284–288. doi:10.1107 / S0365110X58000694. Olingan 2010-05-21.
- ^ N. N. Grinvud, A. Ernsou, Elementlar kimyosi, 2-nashr, Butterworth-Heinemann, Oksford, Buyuk Britaniya, 1997 yil
- ^ Kimyo va fizika bo'yicha qo'llanma, 71-nashr, CRC Press, Ann Arbor, Michigan, 1990 yil
- ^ The Merck indeksi. Kimyoviy moddalar, giyohvand moddalar va biologik moddalar entsiklopediyasi. 14. Ed., 2006, p. 780, ISBN 978-0-911910-00-1.
- ^ X. Nechamkin, Elementlar kimyosi, McGraw-Hill, Nyu-York, 1968 yil
- ^ A. F. Uells, Strukturaviy noorganik kimyo, 5-nashr, Oxford University Press, Oksford, Buyuk Britaniya, 1984 yil
- ^ G. Dayker, Bir hil kataliz uchun Eldorado?, yilda Organik sintezning muhim voqealari V, H.-G. Shmaltz, T. Virt (tahr.), 48−55-betlar, Vili-VCH, Vaynxaym, 2003
- ^ Y. Fukuda; K. Utimoto (1991). "Faollashtirilmagan alkinlarni ketonlarga yoki oltin (III) katalizator bilan asetallarga samarali o'zgartirish". J. Org. Kimyoviy. 56 (11): 3729. doi:10.1021 / jo00011a058.
- ^ A. S. K. Xashmi; T. M. Frost; J. W. Bats (2000). "Yuqori darajada tanlangan oltin-katalizli Arene sintezi". J. Am. Kimyoviy. Soc. 122 (46): 11553. doi:10.1021 / ja005570d.
- ^ A. Stiven; K. Xashmi; M. Rudolph; J. P. Veyrauch; M. Volfle; W. Frey; J. W. Bats (2005). "Oltin katalizi: Fenol sintezidagi oraliq moddalar sifatida Arene oksidlarini isbotlash". Angewandte Chemie International Edition. 44 (18): 2798–801. doi:10.1002 / anie.200462672. PMID 15806608.
- ^ Li, Zigang; Brouwer, Chad; U, Chuan (2008-08-01). "Oltin katalizli organik transformatsiyalar". Kimyoviy sharhlar. 108 (8): 3239–3265. doi:10.1021 / cr068434l. ISSN 0009-2665. PMID 18613729.