Uran geksaxloridi - Uranium hexachloride
 | |
| Ismlar | |
|---|---|
| IUPAC nomi Uran (VI) xloridi | |
| Boshqa ismlar Uran geksaxloridi Peruranik xlor | |
| Identifikatorlar | |
3D model (JSmol ) | |
| ChemSpider | |
PubChem CID | |
| |
| |
| Xususiyatlari | |
| UCl6 | |
| Molyar massa | 450,745 g / mol |
| Tashqi ko'rinishi | quyuq yashil kristalli qattiq |
| Zichlik | 3600 kg / m3 |
| Erish nuqtasi | 177 ° C (351 ° F; 450 K) |
| Qaynatish nuqtasi | 75 ° C (167 ° F; 348 K) |
Boshqacha ko'rsatilmagan hollar bundan mustasno, ulardagi materiallar uchun ma'lumotlar keltirilgan standart holat (25 ° C [77 ° F], 100 kPa da). | |
| Infobox ma'lumotnomalari | |
Uran geksaxloridi (UCl6) an noorganik kimyoviy birikma ning uran +6 da oksidlanish darajasi.[1][2] UCl6 tarkibiga metall galogenid kiradi uran va xlor. Bu 373,15 K da bug 'bosimi 1-3 mmHg gacha bo'lgan ko'p lyuminestsent quyuq yashil kristalli qattiq moddadir.[3] UCl6 a da barqaror vakuum, quruq havo, azot va geliy da xona harorati. U ichida eriydi to'rt karbonli uglerod (CCl4). Boshqa uran halogenidlari bilan taqqoslaganda UCl haqida kam narsa ma'lum6.
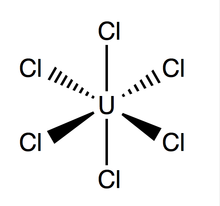
Tuzilishi va yopishtirilishi
Uran geksaxlorid an oktahedral geometriya, bilan nuqta guruhi Oh. Uning panjara (o'lchamlari: 10.95 ± 0.02 Å x 6.03 ± 0.01 Å) olti burchakli shaklga ega bo'lib, bitta hujayra uchun uchta molekula mavjud; o'rtacha nazariy U-Cl bog'lanish uzunligi 2.472 Å (tajriba U-Cl uzunligi tomonidan topilgan Rentgen difraksiyasi 2.42 ga teng),[4] va ikkita qo'shni xlor atomlari orasidagi masofa 3,65 is.
Kimyoviy xususiyatlar
Uran geksaxloridi yuqori darajada gigroskopik oddiy atmosfera sharoitida aralashgan va tezda parchalanadi.[5] shuning uchun uni vakuum apparatida yoki quruq qutida ishlash kerak.
Termal parchalanish
UCl6 120 ° C dan 150 ° C gacha bo'lgan haroratgacha barqaror. The parchalanish UCl6 UCl ning bitta kristall shaklidan qattiq fazali o'tishga olib keladi6 yana barqaror shaklga.[6] Biroq, parchalanish ning gazsimon UCl6 UCl ishlab chiqaradi5. The faollashtirish energiyasi chunki bu reaktsiya uchun taxminan 40 kkal mol.
- 2 UCl6 (g) → 2 UCl5 (lar) + Cl2 (g)
Eriydiganlik
UCl6 juda emas eriydi birikma. U CClda eriydi4 jigarrang eritma berish. U izobutil bromidda va ftorokarbonda (C.) Ozgina eriydi7F16).[7]
| Erituvchilar | Harorat (° C) | UCl grammlari6/ 100 g eritma |
|---|---|---|
| CCl4 | −18 | 2.64 |
| CCl4 | 0 | 4.9 |
| CCl4 | 20 | 7.8 |
| 6.6% Cl2 : 93.4% CCl4 | −20 | 2.4 |
| 12.5% Cl2 : 87.5% CCl4 | −20 | 2.23 |
| 12.5% Cl2 : 87.5% CCl4 | 0 | 3.98 |
| Suyuq Cl2 | −33 | 2.20 |
| CH3Cl | −24 | 1.16 |
| Benzol | 80 | Erimaydi |
| Freon 113 | 45 | 1.83 |
Ftorli vodorod bilan reaktsiya
UCl bo'lganda6 tozalangan suvsiz suyuqlik bilan reaksiyaga kirishadi ftorli vodorod (HF) xona haroratida hosil bo'ladi UF5.[8]
- 2 UCl6+ 10 HF → 2 UF5 + 10 HCl + Cl2
Sintez
Uran geksaxloridni reaktsiyasidan sintez qilish mumkin uran trioksidi (UO3) suyuq CCl aralashmasi bilan4 va issiq xlor (Cl.)2). Reaktsiya UCl ishtirokida olib borilsa, hosilni oshirish mumkin5.[9] UO3 UCl ga aylantiriladi5, bu o'z navbatida ortiqcha Cl bilan reaksiyaga kirishadi2 UCl hosil qilish uchun6. Buning uchun katta miqdordagi issiqlik kerak reaktsiya amalga oshmoq; harorat oralig'i miqdoriga qarab 65 ° C dan 170 ° C gacha reaktiv (ideal harorat 100 ° C - 125 ° C). Reaksiya yopiq gaz o'tkazmaydigan idishda amalga oshiriladi (masalan, a qo'lqop qutisi ) paydo bo'ladigan bosimga dosh bera oladigan.
1-qadam: UO3 + 5 Cl2 → 2 UCl5 + 3 O2
2-qadam: UCl5 + Cl2 → 2 UCl6
Umumiy reaktsiya: 2 UO3 + 6 Cl2 → 2 UCl6 + 3 O2
Ushbu metall geksahalidni Cl ni puflash orqali ham sintez qilish mumkin2 sublimatsiya qilingan UCl orqali gaz4 350 ° C da.[10]
1-qadam UCl4 + Cl2 → 2 UCl5
2-qadam: UCl5 + Cl2 → 2 UCl6
Umumiy reaktsiya: UCl4 + Cl2 → UCl6
Adabiyotlar
- ^ Zachariasen, W. H. (1948). "5f seriyali elementlarni kristalli kimyoviy tadqiqotlar. V. Uraning geksaxloridning kristalli tuzilishi". Acta Crystallographica. 1 (6): 285–287. doi:10.1107 / S0365110X48000788.
- ^ Teylor, J. C .; Wilson, P. W. (1974). "Uran heksaxlorid tuzilishini neytronli va rentgen kukunlari difraksiyasini o'rganish". Acta Crystallographica bo'limi B. 30 (6): 1481. doi:10.1107 / S0567740874005115.
- ^ Van Deyk, R. E.; Evers, E. C. (1955). "Uran geksaxloridini tayyorlash". Google patentlari: 2.
- ^ Batista, E. R .; Martin, R. L .; Hay, P. J. (2004). "UF xususiyatlari va termodinamikasining zichligi bo'yicha funktsional tadqiqotlarn va UCln (n = 1, ..., 6) ". J. Chem. Fizika. 121 (22): 11104–11. doi:10.1063/1.1811607. PMID 15634063.
- ^ Lipkin, D .; Vessman, S. (1955). "Uran geksaxloridini buzilish va ifloslanishdan himoya qilish jarayoni va apparati". Google patentlari: 2.
- ^ Kats, J.J .; Rabinovich, E. (1951). Uran kimyosi. Ann Arbor: McGraw-Hill kitob kompaniyasi.
- ^ Kats, JJ; Rabinovich, E. (1951). Uran kimyosi. Ann Arbor: McGraw-Hill kitob kompaniyasi.
- ^ Kats, JJ; Rabinovich, E. (1951). Uran kimyosi. Ann Arbor: McGraw-Hill kitob kompaniyasi.
- ^ Van Deyk, R. E.; Evers, E. C. (1955). "Uran geksaxloridini tayyorlash". Google patentlari: 2.
- ^ Tornton, G.; Edelshteyn, N .; Rosh, N .; Vudvark, D.R .; Edgell, R.G. (1979). "UCl ning elektron tuzilishi6: Fotoelektron spektrlar va tarqoq to'lqin Xa Hisob-kitoblar ". J. Chem. Fizika. 70 (11): 6. Bibcode:1979JChPh..70.5218T. doi:10.1063/1.437313.
