Kaltsiy sitrat - Calcium citrate
 Kaltsiy sitratining 2D tuzilishi | |
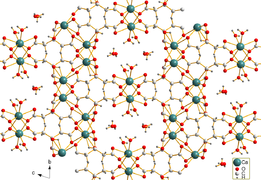 Kaltsiy sitrat tetrahidrat[1] | |
| Ismlar | |
|---|---|
| IUPAC nomi 2-gidroksi-1,2,3-propan-trikarboksilik kislota kaltsiy tuzi (2: 3) | |
| Boshqa ismlar E333, trikalsiyum dikitrat | |
| Identifikatorlar | |
3D model (JSmol ) | |
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| ECHA ma'lumot kartasi | 100.011.265 |
| EC raqami |
|
| E raqami | E333 (antioksidantlar, ...) |
PubChem CID | |
| UNII | |
CompTox boshqaruv paneli (EPA) | |
| |
| |
| Xususiyatlari | |
| Ca3(C6H5O7)2 | |
| Molyar massa | 498,4334 g / mol (suvsiz) 570.4945 g / mol (tetrahidrat) |
| Tashqi ko'rinishi | Oq chang |
| Hidi | hidsiz |
| Zichlik | 1,63 g / sm3 (suvsiz) 2.00 g / sm3 (tetrahidrat)[1] |
| Erish nuqtasi | Parchalanadi |
| Qaynatish nuqtasi | Parchalanadi |
| 0,85 g / L (18 ° C) 0,95 g / L (25 ° C) | |
| Eriydiganlik | ichida erimaydi spirtli ichimliklar |
| Tuzilishi | |
| Triklinik (tetrahidrat) | |
| P1, № 2 | |
a = 0,59466 (4) nm, b = 1.02247 (8) nm, v = 1.66496 (13) nm a = 72.213 (7) °, β = 79.718 (7) °, ph = 89.791 (6) °[1] | |
| Xavf | |
| Asosiy xavf | Irritant |
| NFPA 704 (olov olmos) | |
| Tegishli birikmalar | |
Boshqalar kationlar | Natriy sitrat |
Boshqacha ko'rsatilmagan hollar bundan mustasno, ulardagi materiallar uchun ma'lumotlar keltirilgan standart holat (25 ° C [77 ° F], 100 kPa da). | |
| Infobox ma'lumotnomalari | |
Kaltsiy sitrat bo'ladi kaltsiy tuzi ning limon kislotasi. Odatda a sifatida ishlatiladi oziq-ovqat qo'shimchasi (E333 ), odatda konservant, lekin ba'zan uchun lazzat. Shu ma'noda, u shunga o'xshashdir natriy sitrat. Kaltsiy sitrat, shuningdek, ba'zi bir parhezli kaltsiy qo'shimchalarida (masalan, Sitrakal) mavjud. Kaltsiy massasi bo'yicha 24,1% kaltsiy sitrat (suvsiz) va 21,1% kaltsiy sitrat (tetrahidrat) ni tashkil qiladi. Tetrahidrat tabiatda mineral sifatida uchraydi Earlandite.
Kimyoviy xususiyatlari
Kaltsiy sitrat suvda kam eriydi. Tricalcium dicitrate tetrahidratning igna shaklidagi kristallari [Ca3(C6H5O7)2(H2O)2] · 2H2O, gidrotermal sintez orqali olingan. Kristal tuzilishi uch o'lchovli tarmoqni o'z ichiga oladi, unda sakkiz marta koordinatali Ca2+ kationlar sitrat anionlari va vodorod bog'lanishlari bilan ikkita muvofiqlashtirilmagan kristalli suv molekulalari va ikkita muvofiqlashtiruvchi suv molekulalari o'rtasida bog'langan.[1]
Ishlab chiqarish
Kaltsiy sitrat izolyatsiyalashda oraliq hisoblanadi limon kislotasi dan fermentatsiya limon kislotasi sanoat ishlab chiqarish jarayoni.[2] Bulyon eritmasidagi limon kislotasi neytrallashtiriladi kaltsiy gidroksidi, cho'ktiruvchi erimaydigan kaltsiy sitrat. Keyin bu bulonning qolgan qismidan filtrlanadi va toza kaltsiy sitrat berish uchun yuviladi.
- 3 Ca (OH)2 (lar) + 2 C6H8O7 (l) → Ca3(C6H5O7)2 (lar) + 6 H2O(l)
Shunday qilib ishlab chiqarilgan kaltsiy sitrat mavjud holatda sotilishi yoki suyultirilgan sulfat kislota yordamida limon kislotasiga aylanishi mumkin.
Biologik roli
Ko'pgina odamlarda, bioavailability kaltsiy sitrat arzonroq bilan teng ekanligi aniqlandi kaltsiy karbonat.[3] Ammo ovqat hazm qilish traktidagi o'zgarishlar kaltsiyning qanday hazm bo'lishini va so'rilishini o'zgartirishi mumkin. Kaltsiy karbonatidan farqli o'laroq, bu asosiy va oshqozon kislotasini neytrallashtiradi, kaltsiy sitrat oshqozon kislotasiga ta'sir qilmaydi.[4] Kaltsiy karbonat hazm qilish kaltsiy sitratiga qaraganda qiyinroq,[4] va kaltsiy karbonat "kislota qayta tiklanishi" xavfini keltirib chiqaradi (oshqozon ko'proq kislota ishlab chiqarish orqali kompensatsiyalanadi),[4] shuning uchun antatsidlarga sezgir bo'lgan yoki etarli miqdorda oshqozon kislotasini ishlab chiqarishda qiynaladigan odamlar qo'shimcha qilish uchun kaltsiy karbonat o'rniga kaltsiy sitratini tanlashlari mumkin. Oshqozon-ichak operatsiyasidan keyin kaltsiyni emdirish bo'yicha so'nggi tadqiqotlarga ko'ra,[5] kaltsiy sitrat, kaltsiy sitratini kaltsiy sitratini qabul qiladigan Roux-en-Y gastrik bypassli bemorlarda kaltsiy karbonat ustidan biologik mavjudligini yaxshilagan bo'lishi mumkin xun takviyesi operatsiyadan keyin. Bu, asosan, ushbu odamlarning ovqat hazm qilish traktida kaltsiyning emishi sodir bo'ladigan joy bilan bog'liq o'zgarishlarga bog'liq.
Adabiyotlar
- ^ a b v d Herdtvek, Eberxardt; Kornprobst, Tobias; Siber, Roland; Straver, Leo; Plank, Johann (2011). "Tri-kaltsiy di-sitrat tetra-gidratning kristal tuzilishi, sintezi va xususiyatlari [Ca3(C6H5O7)2(H2O)2] · 2H2O ". Zeitschrift für anorganische und allgemeine Chemie. 637 (6): 655–659. doi:10.1002 / zaac.201100088.
- ^ "Kimyoviy sanoatda ohakdan foydalanish". Milliy ohak assotsiatsiyasi. Arxivlandi asl nusxasi 2006-09-29 kunlari. Olingan 2006-11-25.
- ^ Heaney RP, Dowell MS, Bierman J, Hale CA, Bendich A (2001). "Kaltsiyni qo'shib olishda so'rilishi va iqtisodiy samaradorligi". Amerika oziqlanish kolleji jurnali. 20 (3): 239–46. doi:10.1080/07315724.2001.10719038. PMID 11444420. S2CID 206488.
- ^ a b v "Kaltsiy haqida nimalarni bilishingiz kerak". Garvard sog'liqni saqlash nashrlari. Olingan 4 avgust 2014.
- ^ Tondapu P, Provost D, Adams-Xuet B, Sims T, Chang S, Saxa K (iyun 2009). "Roux-en-Y me'da-ichak yo'lidan keyin kaltsiy karbonat va kaltsiy sitratning yutilishini taqqoslash". Semirib ketish bo'yicha jarrohlik. 19 (9): 1256–1261. doi:10.1007 / s11695-009-9850-6. PMC 4469176. PMID 19437082.

